
本制品是基于生物素(Biotin)与链霉亲和素(Streptavidin)的亲和力强于HABA与Streptavidin的亲和力,通过生物素、生物素标记的抗体或蛋白等的强竞争使HABA与Streptavidin解离,导致HABA与Streptavidin结合时500nm处吸光度(A500)的降低,从而定量检测抗体或蛋白等被生物素标记水平或样品中生物素浓度的试剂盒。
本试剂盒操作简单,检测速度快,完成检测仅需约5分钟,不仅适合少量样本的检测,也非常适合高通量筛选的自动化操作系统。

HABA是一种能与链霉亲和素发生弱相互作用的染料。游离的HABA在356nm处吸光度有最大吸收峰,当HABA与链霉亲和素(Streptavidin)或亲和素(Avidin)结合形成复合物后产生红移现象,其最大吸收峰红移至500nm处。与生物素和链霉亲和素的高亲和力(Kd=1×10-15M)相比,HABA和链霉亲和素的亲和力较弱(Kd=5.8×10-6M),所以当溶液中存在生物素时,生物素会强竞争使HABA与链霉亲和素解离,导致HABA与Streptavidin结合时500nm处的吸光度降低。因此HABA常用于测定抗体或蛋白等被生物素化程度,吸光度与样品的生物素摩尔量成负相关(图1),即吸光度越低,抗体或蛋白的生物素化越高。
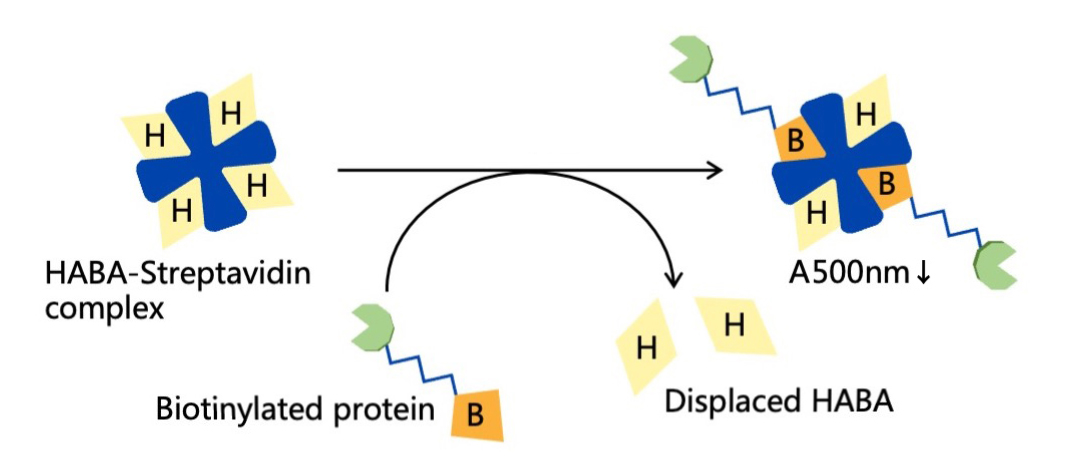
图1.生物素定量检测试剂盒(显色法)的工作原理图。

| 组分 | 100T | 500T |
| HABA/Streptavidin Premix | 2mL | 10mL |
| Reaction Buffer | 20mL | 100mL |
| Biotin Standard (500μM) | 1mL | 5mL |
| Biotin-BSA | 200μL | 500μL |
保存:-20℃,有效期1年。

按照每孔200μL反应体系,本试剂盒检测生物素浓度的下限为2μM (400pmol),通常每孔需要5~20μg生物素标记的抗体或蛋白。如果待检测样品总量有限或浓度较低(例如:生物素标记的多肽、DNA或RNA),推荐使用荧光法的生物素标记水平检测试剂盒,荧光法相比于显色法的灵敏度提高约50倍,按照每孔反应体系为100μL,检测生物素浓度的下限为40nM(4pmol),通常每孔需要50ng~1μg生物素标记的抗体或蛋白或5~100pmol生物素标记的多肽、DNA或RNA。

- Reaction Buffer在-20℃保存后融化如果有沉淀析出,可37℃水浴加热直至完全溶解。
- 所有试剂需完全解冻并平衡至室温后再使用,使用完毕后各试剂应立即按照试剂盒要求的条件保存。
- Biotin-BSA仅作为生物素标记的阳性对照,不提供具体的生物素标记数量。

- 生物素标记或生物素的定量检测
- 将HABA/Streptavidin Premix、待测生物素标记的抗体或蛋白样品或含有生物素的样品平衡至室温。
- 将160μL Reaction Buffer,20μL HABA/Streptavidin Premix依次加至96孔平底板,轻轻混匀,避免起泡。
- 使用具有检测500nm吸光度功能的酶标仪进行吸光度检测,此数值记录为A500HABA/Streptavidin (A500H/S)。
- 将96孔平底板从酶标仪中取出,向不同孔中分别加入20μL的Biotin-BSA (阳性对照)、Reaction Buffer (阴性对照)或样品,轻轻混匀,避免起泡。
- 再次使用具有检测500nm吸光度功能的酶标仪进行吸光度检测,此数值记录为A500HABA/Streptavidin/Biotin(A500H/S/B)。
- 如果A500 H/S/B<0.25,建议用Reaction Buffer对生物素标记的抗体或蛋白进行稀释后再次检测;
- 如果A500H/S/B>0.9,建议对生物素标记的抗体或蛋白进行浓缩后再次检测。
- 如果A500 H/S/B<0.25,建议用Reaction Buffer对生物素标记的抗体或蛋白进行稀释后再次检测;
- 将HABA/Streptavidin Premix、待测生物素标记的抗体或蛋白样品或含有生物素的样品平衡至室温。
- 生物素标记或生物素的直接定量计算
- 计算加入样品前后HABA/Streptavidin Premix 500nm吸光度的差值:ΔA500=A500H/S-A500H/S/B
- 计算反应体系中Biotin的摩尔浓度(mM):Biotin(mM)=Biotin(nm)
Reaction micture(mL)=ΔA500
34500M-1 cm-1×0.5cm- HABA/Streptavidin复合物在500nm吸光度的消光系数为34500M-1cm-1。
- 通常96孔平底板200μL溶液的光路长度为0.5cm。
- 如果是生物素标记抗体或蛋白,计算被生物素标记的抗体或蛋白的摩尔浓度(mM):Protein(mM)=蛋白浓度(mg/mL)
蛋白分子量(Da)- 蛋白浓度(mg/mL)指未经过任何稀释被测抗体或蛋白的浓度。如果蛋白浓度不知道,可以不进行计算。
- 如果是生物素标记抗体或蛋白,计算生物素/抗体或蛋白的摩尔比(计算所得数值即为每个抗体或蛋白被标记生物素的平均个数):
Biotin (mM)
Protein(mM)=Biotin(mM)×10×Dilution factor
Protein(mM)- "10"指20μL样品加入到180μL反应液(步骤1d)后被稀释了10倍。
- Dilution factor指因初始时生物素标记的抗体或蛋白浓度过高导致A500H/S/B<0.25,而额外对生物素标记的抗体或蛋白进行稀释的倍数。
- 计算示例:
BSA:分子量66430Da,浓度2.6mg/mL,A500H/S=0.8693,A500H/S/B=0.6227Protein (mM)=蛋白浓度(mg/mL)
蛋白分子量(mg/mmol)=2.6(mg/mL)
66430(mg/mmol)=3.9×10-5ΔA500=A500H/S-A500H/S/B=0.8693-0.6227=0.2466Biotin(mM)=Biotin(nm)
Reaction micture(mL)=ΔA500
34500M-1×0.5cm= 0.2466
34500M-1×0.5cm=1.429×10-5Biotin(mM)
Protein(mM)= Biotin(mM)×10×dilution factor
Protein(mM)=1.429×10-5×10×1
3.9×10-5=3.65生物素分子/BSA分子- 生物素标记或生物素的定量检测和计算(Biotin标准曲线法)
为避免可能的消光系数和光径的差错,可以尝试Biotin标准曲线法。- 将HABA/Streptavidin Premix、Biotin Standard (500μM)和待测生物素标记的抗体或蛋白样品平衡至室温。
- Biotin标准曲线组:分别取0、1、2、4、6、8、10、12、14、16μL的Biotin Standard (500μM)溶液加至96孔平底板,并用Reaction Buffer补足至20μL,然后每孔依次加入160μL Reaction Buffer,20μL HABA/Streptavidin Premix,轻轻混匀,避免起泡。此时,Biotin标准曲线的Biotin浓度和物质的量分别为0、2.5、5、10、15、20、25、30、35、40μM和0、0.5、1、2、3、4、5、6、7、8nmol。
- 样品组:将20μL样品,160μL Reaction Buffer,20μL HABA/Streptavidin Premix加至96孔平底,轻轻混匀,避免起泡。
- 使用具有检测500nm吸光度功能的酶标仪进行吸光度检测,记录A500读值。Biotin浓度为0的孔记为空白对照:A500Blank Control,Biotin标准曲线组记为A500Biotin Standard,样品组记为A500Sample。
- 如果A500Sample<0.25,建议用Reaction Buffer对生物素标记的抗体或蛋白进行稀释后再次检测;
- 如果A500Sample>0.9,建议对生物素标记的抗体或蛋白进行浓缩后再次检测。
- 如果A500Sample<0.25,建议用Reaction Buffer对生物素标记的抗体或蛋白进行稀释后再次检测;
- 以Biotin物质的量(nmol)为X轴,ΔA500Biotin Standard=A500Blank Control-A500Biotin Standard为Y轴,建立标准曲线(直线线性关系) (如图2所示),拟合得到公式。
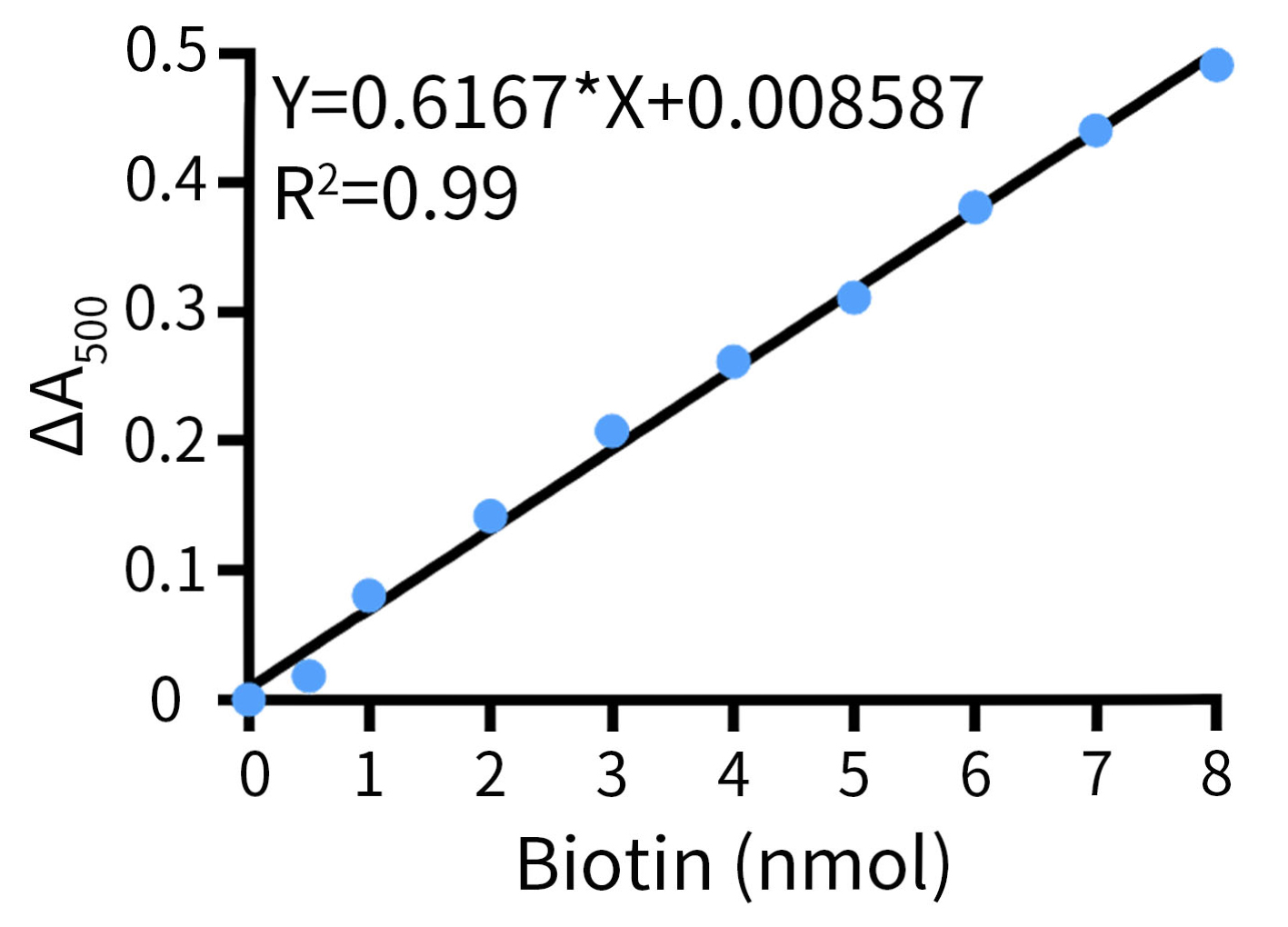
图2.生物素定量检测试剂盒(显色法)的Biotin标准曲线示意图。实际检测数据会因实验条件、检测仪器等的不同而存在差异,图中数据仅供参考。 - 将ΔA500Sample=A500Blank Control-A500Sample作为Y值代入拟合得到的公式,求解得到的X值即为每个孔中含有生物素(Biotin)物质的量(nmol)。
- 计算样品中生物素标记或生物素的浓度(μM):Sample(μM)=Sample(nmol)
20μL×103
相关搜索:生物素定量检测试剂盒(显色法),生物素定量检测,生物素检测,生物素化水平检测,生物素标记效率检测,生物素化蛋白检测,生物素化抗体检测,生物素标记DNA检测,生物素标记RNA检测,Biotin Quantitation Assay Kit(Colorimetric)
- 计算加入样品前后HABA/Streptavidin Premix 500nm吸光度的差值:



